Почему мы толстеем при хроническом стрессе
Разругался с любимым, на носу экзамены, начальство завалило работой – и вот уже любимые джинсы не застегиваются! Почему так происходит? В норме популяция адипоцитов – наших жировых клеток, ежегодно обновляется примерно на 8% за счет созревания клеток-предшественников, в избытке присутствующих в жировой ткани. Но все меняется в ситуации хронического стресса или сбоя режима сна и бодрствования, сопровождающегося повышением уровня глюкокортикоидных гормонов. Эти гормоны стимулируют активное созревание все новых адипоцитов, в которых накапливается жир. То же самое случается и при регулярном приеме лекарств, содержащих глюкокортикоиды. Исследованием молекулярных механизмов этого явления и поиском способов борьбы с ним занимаются ученые из Стэндфордского университета (США)
Уровень глюкокортикоидов в организме здорового человека подчиняется суточным (циркадным) ритмам: он достигает минимума в ночное время и максимума утром, когда надо просыпаться и вставать. При кратковременном стрессе концентрация глюкокортикоидов в кровотоке увеличивается ненадолго, но хронический стресс или нарушения нормального ритма сна и бодрствования, например, при сменной работе, вызывает устойчивое повышение их уровня. Результат плачевный – рост численности адипоцитов, запасающих жир, увеличение массы тела.
Почему это происходит? Ведь нормальное суточное пульсирование содержания в крови этих гормонов, также, как и его кратковременный рост, не имеют таких нежелательных последствий?
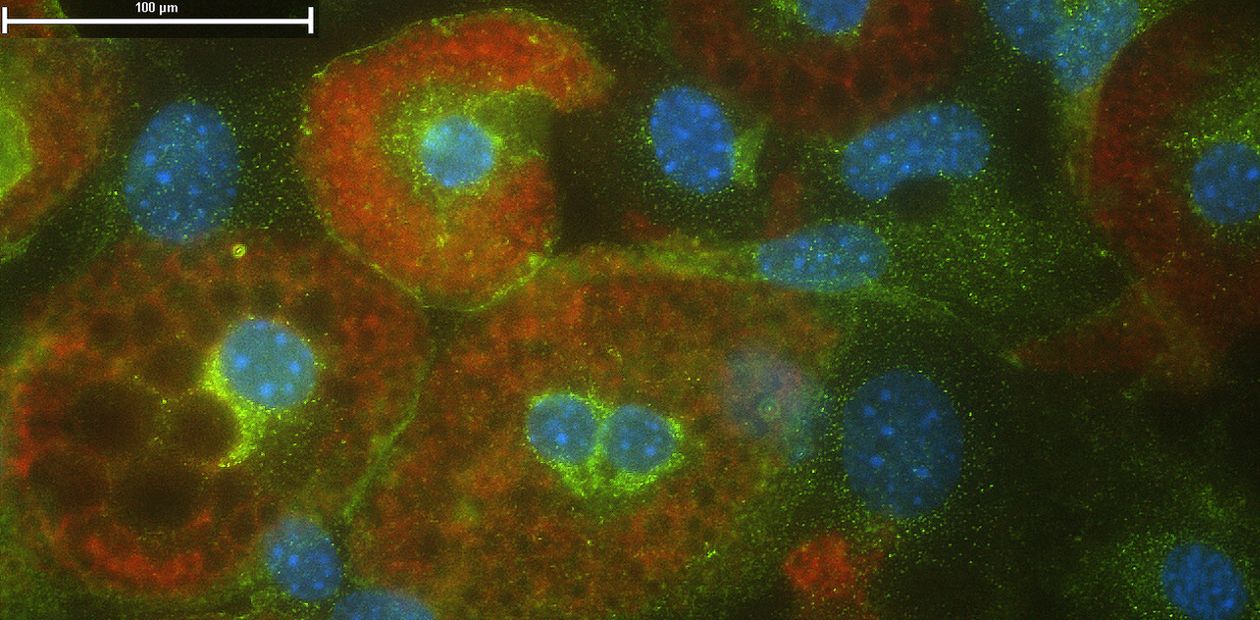
Ученые провели эксперименты, в ходе которых к культуре преадипоцитов (предшественников жировых клеток) добавляли глюкокортикоиды в разном режиме. Затем все клетки окрашивали флюоресцентными красителями и подсчитывали, сколько из предшественников превращалось в зрелые адипоциты. Оказалось, что в результате двухсуточного контакта с глюкокортикоидами такую трансформацию претерпело большинство клеток-предшественников, а вот контакт продолжительностью 12 часов и менее практически не повлиял на интенсивность этого процесса.
Известно, что для созревания адипоцитов критическое значение имеет активация белка PPAR-гамма, уровень которого должен достичь определенного порогового значения. Исследователи проверили предположение, что активация этого белка происходит в результате работы двух петель обратной связи – «быстрой» и «медленной». В первом случае идет последовательная взаимная активация белков PPAR-гамма и CEBP-альфа. Повышение уровня глюкокортикоидов запускает этот цикл, но если их концентрация после этого начнет падать, то цикл останавливается, при этом уровень PPAR-гамма редко успевает достичь порога, необходимого для запуска процесса созревания адипоцитов.
«Медленным» активатором PPAR-гамма в петле положительной обратной связи оказался другой белок – FABP4. Матричная РНК гена, кодирующего этот белок, деградирует гораздо медленнее, чем мРНК для PPAR-гамма, соответственно, медленнее снижается и уровень белка FABP4, поэтому цикл взаимной активации длится дольше. В результате в присутствии высоких концентраций глюкокортикоидов уровень PPAR-гамма неуклонно возрастает и в конце концов переходит порог, за которым начинается превращение преадипоцита в зрелую жировую клетку.
Чтобы смоделировать хронический стресс на животных, ученые имплантировали лабораторным мышам капсулу, медленно и постоянно высвобождающую в кровь глюкокортикоидный гормон кортикостерон. Контрольным мышам имплантировали пустую капсулу. Через три недели жировая масса экспериментальных животных удвоилась, хотя все животные питались одинаково. Увеличение жира, как и ожидалось, произошло за счет роста уже существующих и созревания новых жировых клеток.
Однако в другом варианте эксперимента, когда исследователи делали животным инъекцию кортикостерона во время наступления физиологического пика уровня глюкокортикоидов, ожирение не развивалось, даже если концентрация гормона в крови в этот момент превышала нормальную в десятки раз.
Результаты этих исследований могут помочь в решении задачи контроля роста жировой ткани под действием глюкокортикоидов. Например, на их основе можно разработать схемы лечения гормоносодержащими препаратами, которые не будут провоцировать развитие ожирения. Ну а для обыденной жизни можно дать лишь один совет – не поддавайтесь стрессу!
Фото: https://commons.wikimedia.org
Подготовила Мария Перепечаева