Загадки «ржавой» ДНК
Хранительница наследственной информации — ДНК — уязвима для самых разных факторов внешней среды: солнечного света, радиации, даже продуктов жизнедеятельности собственной клетки… Трудно представить, каким бы стал наш мир, если бы в каждой клетке специальные белки не «патрулировали» наследственный материал, защищая его от появления мутаций...
Сейчас уже не узнать, когда это случилось в истории английской правящей династии — то ли в конце 1737 г., когда Августа Саксен-Готская, жена принца Уэльского, готовилась произвести на свет наследника, то ли гораздо раньше. Не узнать точно и причин этого события: может быть, из глубин космоса прилетела частица с высокой энергией, поразив ДНК венценосной особы, или молекула фермента в половой клетке, замешкавшись на ничтожную долю секунды, допустила ошибку в работе...
Известны только последствия этого микроскопического события, аукнувшиеся по всему земному шару. Ребенок, которому было суждено стать английским королем Георгом III, родился нормальным, хотя и недоношенным, но с возрастом появились серьезные проблемы. Властитель Англии страдал от резких болей в животе, учащенного сердцебиения и неврозов, иногда впадая в безумие на месяцы. Во время одного из таких припадков он и подписал акт о введении налога на импорт чая в американские колонии, ставший последней каплей, спровоцировавшей знаменитое Бостонское чаепитие, а затем и Американскую революцию. Современные врачи довольно уверенно ставят Георгу III диагноз мозаичная порфирия – наследственная болезнь, вызванная дефектом в гене одного из ферментов синтеза гемоглобина. Фермент работает хуже, гемоглобин синтезируется медленно, а накапливающиеся промежуточные продукты отравляют организм.
Вот так всего одна мутация определила в итоге со¬временную карту мира и расстановку сил в нем. Другой широко известный пример – гемофилия (неспособность крови сворачиваться) у русского царевича Алексея, во многом поспособствовавшая падению дома Романовых. Страшно подумать, что было бы, если бы мутации происходили сплошь и рядом! Даже не касаясь политических осложнений, можно уверенно утверждать, что жизнь на Земле была бы совершенно другой. Но мутации, к счастью, — вещь достаточно редкая.
Комплементарны, как вилка с розеткой
Знаменитый физик Э. Шредингер в своей работе «Что такое жизнь? С точки зрения физика» отстаивал идею, что наследственное вещество настолько химически стабильно, что изменений в нем просто не возникает.
Теперь-то мы знаем, что это далеко не так. Если наследственный материал одной человеческой клетки представить в виде Транссибирской магистрали — от Москвы до Владивостока, то за один день в нем появляется столько повреждений, как если бы на каждые сто метров рельсов нашей железной дороги происходила одна поломка.
Шредингера, впрочем, можно понять: его книга была написана в 1944 г., почти за десятилетие до открытия структуры ДНК (слово «ДНК» в ней вообще не упоминается). Да и вряд ли физик мог хорошо ориентироваться в многочисленных работах биологов, которые примерно в те же годы закладывали основы современных представлений о механизмах появления мутаций. Так что писал он «из общих соображений» и, как часто в таких случаях бывает, промахнулся.
Выходит, что большинство повреждений, возникающих в наследственном материале, клетка способна исправить. Этот процесс, открытый в конце 1940-х гг. и активно с тех пор изучаемый, получил название репарации ДНК.
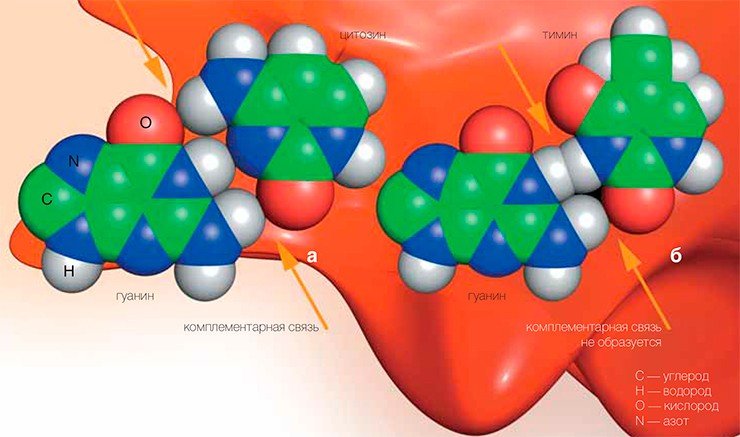
Чтобы понять этот механизм, надо для начала вспомнить несложные факты из школьной программы. Информация в ДНК записана всего четырьмя «буквами»: А, Г, Т и Ц. Роль букв играют так называемые азотистые основания — аденин, гуанин, тимин и цитозин соответственно, которые могут образовывать друг с другом связи, точно соответствуя одно другому, как, скажем, электрическая вилка и розетка. Поэтому в двойной спирали ДНК напротив А всегда стоит Т, а напротив Г — всегда Ц. Биологи говорят, что эти основания комплементарны друг другу. Попытка поставить, например, А напротив Ц сродни попытке воткнуть российскую вилку в американскую розетку с плоскими отверстиями.
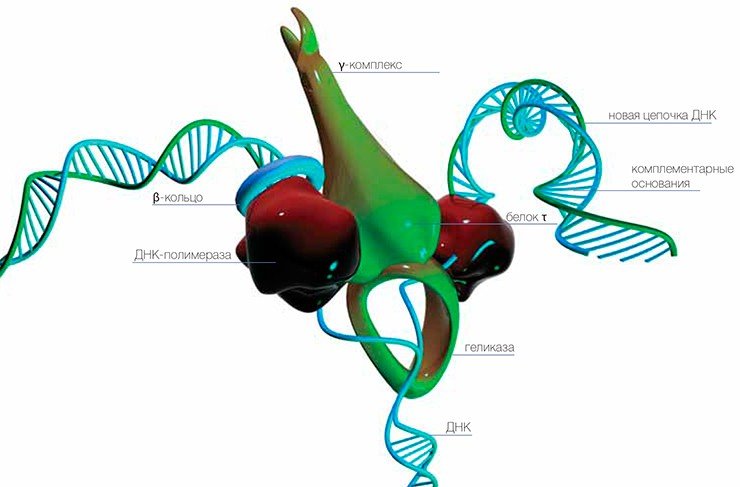
Еще в клетке присутствуют особые белки, ДНК-полимеразы, которые могут «читать» одну цепочку ДНК и по ней собирать противоположную цепочку. Понятно, что из последовательности одной цепи последовательность комплементарной цепи выводится однозначно — это и служит основой точной передачи наследственной информации из поколения в поколение.
Но что будет, если вдруг одна буква в цепочке «испортится» — заклеят в розетке одно гнездо? Тогда ДНК-полимераза не будет знать, что следует поставить напротив испорченной буквы. Вставит правильную, комплементарную букву — все останется по-прежнему, вставит неправильную — возникнет изменение в ДНК, то есть мутация. Существуют и другие механизмы возникновения мутаций, но нас сейчас интересует именно этот.
В своей знаменитой статье в журнале «Nature» (1953 г.) первооткрыватели структуры ДНК Д. Уотсон и Ф. Крик описали роль двух комплементарных цепей ДНК в передаче информации, но просмотрели один важный момент, хотя Уотсон потом и утверждал, что просто посчитал ненужным его упоминать. Дело в том, что если одно основание ДНК испортится, то всегда существует возможность его удалить и вставить вместо него правильное — ведь в противоположной цепочке еще осталась неповрежденная буква, по которой можно по принципу комплементарности восстановить «оригинал».
В большинстве случаев репарация именно так и происходит. Специальные белки все время патрулируют ДНК, подобно железнодорожным обходчикам, которые следят за исправностью рельсов. При обнаружении неправильного основания оно удаляется, а потом брешь застраивается по матрице неповрежденной цепочки.
Почему «ржавеет» ДНК
И все же, как именно портятся «буквы» ДНК? Как и с любой сложной вещью, есть много возможных способов это сделать. Многие наслышаны о вреде ультрафиолета: действительно, если осветить ДНК УФ-лучами, в ней образуются сшивки между соседними «буквами», что мешает работе ДНК-полимераз. Но тот же солнечный ультрафиолет в организм человека дальше поверхностного слоя кожи не проникает.
Существуют еще радиационные поражения ДНК. Но все же главные виновники поломок нашей ДНК, как ни странно, связаны с другими — жизненно важными для нас процессами. И одно из первых мест занимают так называемые окислительные повреждения ДНК.
Ионизирующая радиация — один из факторов повреждения нашей ДНК. Главный ее источник — газ радон, выделяющийся из недр планеты практически повсеместно. Другие природные радиоактивные изотопы, накапливающиеся в организме (в основном изотоп калия 40К), вносят в облучение гораздо меньший вклад. Опасность космических лучей невелика, если вы не летаете часто самолетом, а вот для пилотов это существенный источник радиации, превышающий вклад радона более чем вдвое. Все это — неизбежный природный фон, а вот с рукотворными источниками ионизирующих излучений мы чаще всего сталкиваемся в рентгенкабинете. Микроколичества радиоактивных изотопов содержатся в некоторых промышленных товарах, например во многих противопожарных датчиках. Антропогенным источником радона служат строительные материалы: в железобетонных домах его концентрация выше, чем в кирпичных (особенно если они построены не из красного обожженного кирпича), а наименее радиоактивный материал — дерево.На ранней Земле с ее практически бескислородной атмосферой главным врагом ДНК был ультрафиолет: защитного озонового слоя еще не существовало, да и одноклеточные, в отличие от нас с вами, этим излучением просвечиваются насквозь. В те времена никто не «дышал» — обмен веществ был основан не на восстановлении молекулярного кислорода, а на других химических процессах, типа брожения. Но постепенно, благодаря фотосинтезирующим организмам, концентрация кислорода в атмосфере росла, пока около 2 млрд лет назад не достигла «точки Пастера» (около 1%). Это в 20 раз меньше, чем сегодня, но уже достаточно для гораздо более эффективного кислородного метаболизма. Однако кислород — достаточно сильный окислитель, и чтобы направить реакции с ним в нужное русло, приходится идти на ухищрения.
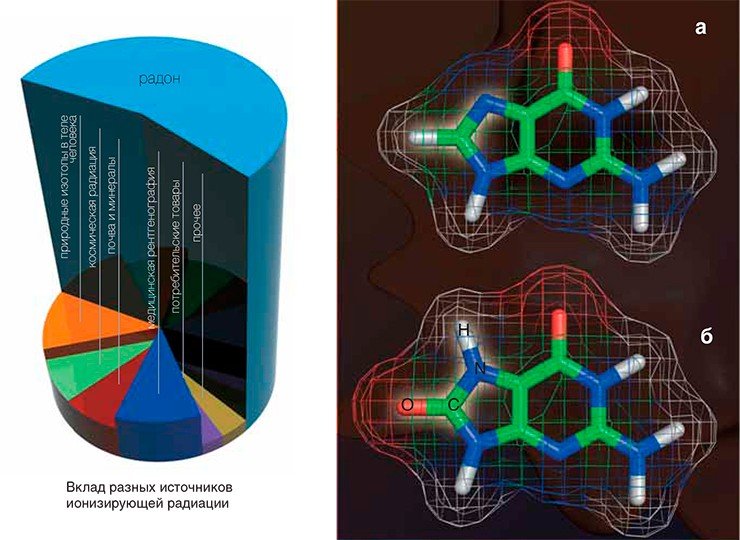
У большинства современных организмов процессы дыхания в клетке сосредоточены в специальных энергетических органеллах — митохондриях. Их возникновение — тема для отдельной статьи, но для нас важно то, что каждая митохондрия представляет собой своеобразный реактор, в котором идет превращение молекул кислорода в воду через промежуточные формы. Последние называют активными формами кислорода за то, что их реакционная способность гораздо выше, чем у молекулярного кислорода и, тем более, воды. Такие молекулы могут легко реагировать с ДНК, окисляя ее, — наследственный материал «ржавеет» в прямом смысле этого слова. Окисляться могут также белки, липиды и другие компоненты клетки, но их легко разрушить и синтезировать заново, а вот уникальные информационные молекулы нужно ремонтировать как можно быстрее!
Всего ученые насчитывают несколько десятков окислительных повреждений ДНК, но не все из них одинаково значимы. Какие-то встречаются чаще, какие-то реже, какие-то приводят к мутации, какие-то нет... У нас же далее речь пойдет о самом, пожалуй, «злокозненном».
Неправильные буквы
В начале 1980-х гг. японское правительство выделило большие деньги для исследования влияния различных способов обработки пищи на здоровье. Возможно, здесь сказалась японская традиция употреблять многие продукты в сыром виде (вспомните знаменитые суси!) и вытекающая из этого подозрительность к жареному и печеному; может быть, японцы просто привыкли тщательно следить за своим самочувствием.
Так или иначе, химики С. Нисимура и Х. Касаи занялись экспериментами, выглядевшими на первый взгляд как классическое любопытство ученого, замечательно изображенное писателем Ю. Томиным: «А что будет, если в медный кофейник вылить стакан кефира, добавить полстакана керосина, опустить сто граммов мороженого, положить старый будильник, выжать половинку лимона, бросить дохлую муху, тщательно размешать, накрыть вчерашней газетой и облучить рентгеновскими лучами?».
Японцы брали концентрированный раствор глюкозы, прогревали его под давлением при температуре 120°С и в полученный коричневый сироп добавляли одно из оснований ДНК — гуанин. После многочасового выдерживания этой смеси в тепле ее разделяли методами аналитической химии и смотрели, во что же превратился гуанин. Как знает любой, кто когда-нибудь лакомился самодельным жженым сахаром, глюкоза при нагревании карамелизуется. В этом сложном процессе (при карамелизации идут химические реакции восьми разных типов, если не больше!) возникают сотни промежуточных веществ, часть из которых очень активна и может реагировать с азотистыми основаниями ДНК. Ученые обнаружили в своем сиропе два производных гуанина, одному из которых суждено было стать печально известным.
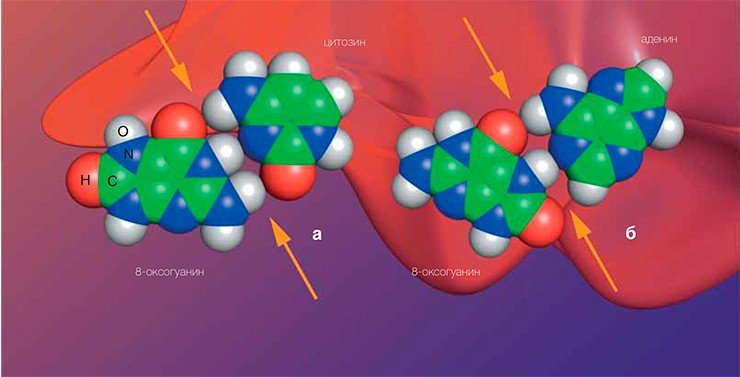
Итак, знакомьтесь — 8-оксогуанин. От гуанина он отличается только двумя атомами, которые даже не участвуют в образовании комплементарных связей в нормальной ДНК. Однако изменения в расположении атомов позволяют окисленному гуанину легко образовывать не только нормальную пару с Ц, но и пару с А. Из-за этого ДНК-полимераза может делать ошибки при копировании цепочки, содержащей 8-оксогуанин, — вставлять напротив него А, в результате при следующем копировании напротив А, естественно, встанет уже Т.
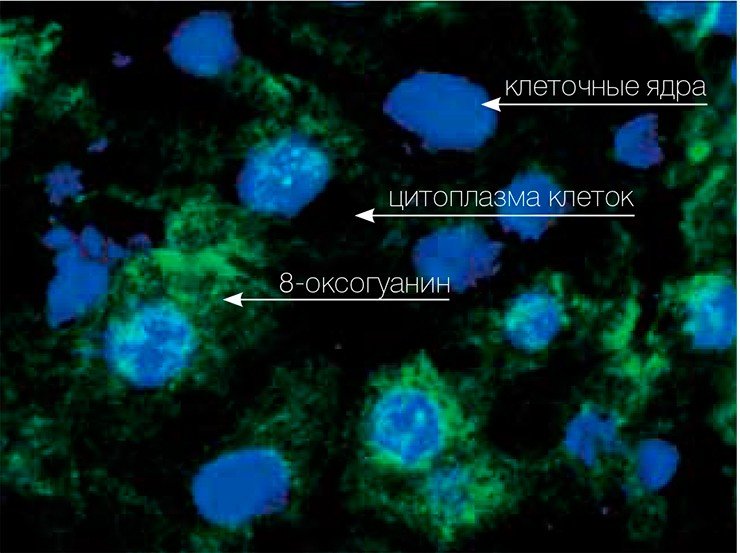
Таким образом, на месте, где изначально была буква Г, появится Т — произойдет мутация, называемая трансверсией. Подобные мутации в ДНК возникают чаще всего как раз по описанному механизму. В некоторых генах человека, мутация в которых приводит к развитию раковых опухолей, такие трансверсии находят очень часто, почему окисление гуанина в ДНК считается сейчас важным онкогенетическим фактором. И в мутантных генах, предопределяющих возникновение тех же порфирии или гемофилии, хватает случаев этой трансверсии.
Однако поначалу сообщение японских ученых не вызвало большого интереса. Мало ли что может образоваться в модельных условиях, да еще таких экзотических, как кипящий сироп. Однако буквально через пару лет в США М. Диздароглу и Р. Флойд разработали надежные методы определения даже очень малых количеств 8-оксогуанина в ДНК, после чего сообщения об этом окисленном основании посыпались градом.
Оказалось, что 8-оксогуанин образуется при воздействии на ДНК очень многих факторов — радиации, солнечного света, разных химических окислителей, табачного дыма, автомобильных выхлопных газов, асбеста... От этого не спасет даже свинцовая камера с тщательно профильтрованным воздухом — как мы видели, в самих клетках митохондрии при дыхании в изобилии производят активные формы кислорода. Теоретически все они должны восстанавливаться до воды, но в мире нет идеально работающих систем, и какая-то часть этих очень реакционно-способных молекул из митохондрий попадает в клеточное ядро, где может повреждать ДНК. И митохондрии — далеко не единственный источник опасных окислителей в организме: например, в иммунной системе человека есть специальные клетки-макрофаги, производящие активные формы кислорода, чтобы с их помощью убивать патогенные микробы.
Поэтому даже в отсутствие внешних повреждающих факторов ДНК каждой клетки содержит несколько тысяч оснований 8-оксогуанина. А уж при наличии таких факторов... Когда подсчитали количество поврежденных оснований в ДНК рыб, обитающих в загрязненной индустриальными стоками гавани американского города Сиэтла, то оказалось, что оно возросло как минимум в тысячи раз по сравнению с нормой. Сейчас 8-оксогуанин считается самым распространенным из окислительных повреждений ДНК, и, поскольку обнаружить его сравнительно легко, часто используется в качестве маркера окислительного стресса.
Путевые обходчики
С самого начала было понятно, что такое важное поврежденное основание должно подвергаться репарации. Оставалось только найти фермент — «путевого обходчика», который ищет 8-оксогуанин в ДНК и удаляет его. Подобные белки, ДНК-гликозилазы, были к тому времени известны, но ни один из них не подходил для репарации 8-оксогуанина.
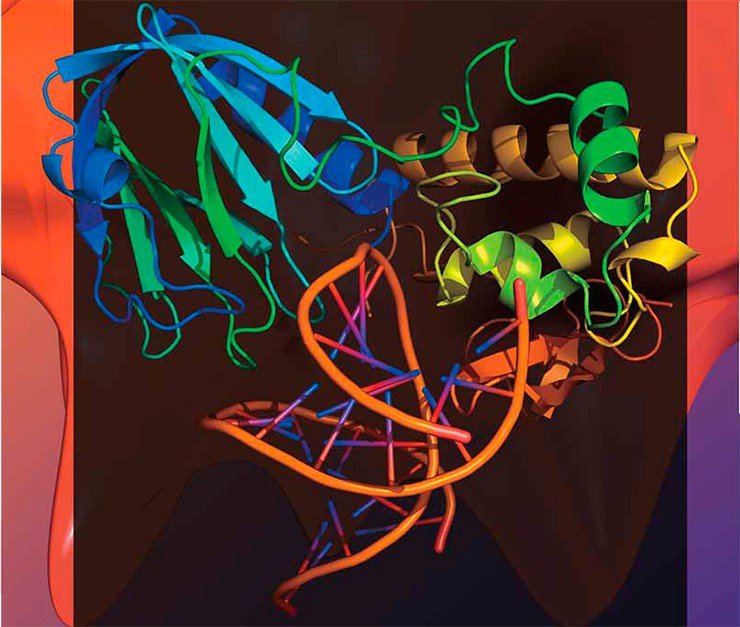
В 1991 г. в американской лаборатории А. Гроллмана из кишечной палочки — рабочей лошадки современной биологии — наконец-то был выделен фермент, способный узнавать и выщеплять из ДНК 8-оксогуанин. Вскоре было показано, что этот фермент идентичен другому белку, открытому незадолго до того, — формамидопиримидин-ДНК-гликозилазе (которая узнавала еще одно окисленное производное гуанина), поэтому за белком закрепилось сокращенное название Fpg.
С тех пор этот фермент интенсивно изучали во многих странах, а в 2002 г. была определена и его пространственная структура в результате совместных усилий ученых из новосибирского Института биоорганической химии (ныне Института химической биологии и фундаментальной медицины) СО РАН, группы Гроллмана и Иерусалимского университета. Решить эту трудоемкую задачу, требующую большого экспериментаторского мастерства, было необходимо для понимания механизма работы фермента — лишь после этого можно задумываться и о его практическом применении.
Сейчас в зарубежных лабораториях пытаются применить белок Fpg в целях предохранения нормальных клеток от повреждений при противоопухолевой химио- и радиотерапии. Новосибирцы исследуют роль этого фермента в жизни бактерии-возбудителя туберкулеза: известно, что подавление некоторых других гликозилаз резко снижает способность туберкулезной палочки выживать в организме инфицированного. В принципе на этой основе могут быть созданы новые лекарства против этой опасной болезни.
Даже в обычных условиях ДНК клетки содержит несколько тысяч молекул 8-оксогуанина — одного из самых распространенных окислительных повреждений наследственной информацииНо вернемся к событиям внутри клетки. Бактериальный фермент Fpg отличается исключительной специфичностью — он способен удалять из ДНК 8-оксогуанин, стоящий напротив «буквы» Ц, но не способен делать это, если напротив поврежденного основания находится А. Это логично: нормальный гуанин всегда комплементарен Ц. Если же 8-оксогуанин стоит напротив А, то это означает, что ДНК-полимераза уже успела скопировать поврежденную цепь ДНК, совершив ошибку в месте повреждения. Поэтому, если удалить 8-оксогуанин из такой пары, сразу возникнет мутация.
Как же клетка выходит из такой ситуации? Оказывается, на этот случай есть еще одна ДНК-гликозилаза — MutY, которая узнает пару 8-оксогуанина с А и удаляет из нее не поврежденную, а нормальную «букву» (аденин). Парадокс? Вовсе нет: теперь ДНК-полимераза может при репарации вставить напротив 8-оксогуанина как Ц, так и А. Вставит Ц — задача сводится к уже известной, и дальше работает белок Fpg. Опять ошибется и вставит А — ничего страшного, цикл повторится еще раз, и еще, и еще... В конце концов на нужное место встанет Ц, и тогда на помощь придет Fpg.
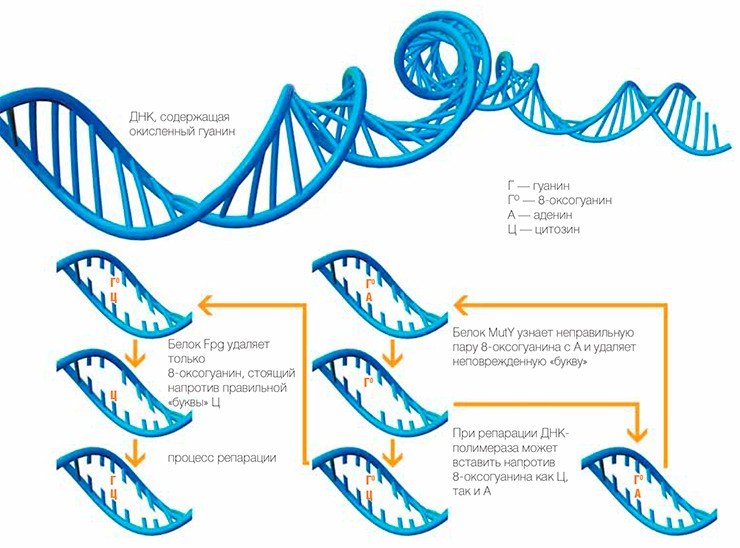
У белков Fpg и MutY есть еще и третий коллега — фермент MutT, удаляющий 8-оксогуанин из поврежденных «кирпичиков»-мономеров, что не позволяет ДНК-полимеразе использовать неправильные «буквы» в качестве строительного материала при формировании новой цепочки. Кстати, названия MutT и MutY происходят как раз от английского mutation — если соответствующие гены у бактерии «выключить», частота мутаций подскочит во много раз.
Описанная система репарации 8-оксогуанина оказалась настолько удобной, что ее можно найти практически у всех живых организмов, в том числе и у нас с вами. Конечно, ферменты могут отличаться от бактериальных по структуре и носить другие названия, но суть остается той же: удалять 8-оксогуанин напротив цитозина, а аденин — напротив 8-оксогуанина.
Кроме того, имеются ферменты, которые не трогают 8-оксогуанин, но удаляют из ДНК другие окисленные основания: у кишечной палочки это белки Nth и Nei, у человека — NTH и несколько белков NEIL. Как и Fpg, все эти компоненты системы репарации служат объектом пристального внимания ученых всего мира.
К счастью, не отстает здесь и Россия, и во многом — благодаря усилиям новосибирских ученых: большой объем исследований по этой тематике выполняется в лаборатории ферментов репарации ИХБФМ СО РАН. Только что из печати вышла научная статья, в которой описываются новые, ранее неизвестные функции вышеупомянутых белков NEIL; ведется определение структур ряда ДНК-гликозилаз; совместно с другими лабораториями Института исследуется динамика структур ферментов, роль репарации ДНК в организме... На всех международных научных форумах, где собираются ученые, занимающиеся репарацией, новосибирцы — желанные докладчики.
Как здоровье?
А что происходит, если наши белковые «путевые обходчики» не выполняют свою работу должным образом? Выше уже упоминались и мутации, и то, что с повышенным уровнем 8-оксогуанина может быть связано зарождение многих раковых опухолей.
Вообще болезни человека, происходящие из-за дефектов системы репарации, протекают очень тяжело, но, к счастью, они довольно редки. Самая известная из них, пожалуй, — пигментная ксеродерма, при которой отсутствует репарация повреждений, вызванных ультрафиолетовым излучением. Для этих больных, которых в мире всего несколько тысяч, любой выход на солнечный свет губителен — кожа быстро покрывается волдырями, на ней развиваются злокачественные опухоли; большинство таких людей умирает еще в молодости. Но ксеродерма вызвана не дефектами ДНК-гликозилаз — при ней не работают другие ферменты.
До недавних пор вообще не было известно болезней, которые возникали бы из-за мутаций в генах ДНК-гликозилаз. Более того, экспериментальное «выключение» этих генов у лабораторных мышей (такие животные называются «нокаутными») также не вызывало никаких заметных неблагоприятных симптомов.
Ситуация изменилась в 2002 г., когда группа английских ученых сообщила о том, что в результате мутации в гене MutY у человека повышается риск заболевания раком толстого кишечника. Практически в то же время было показано, что дефекты в гене урацил-ДНК-гликозилазы (этот фермент репарирует повреждения ДНК, не относящиеся к окислительным) вызывают тяжелую иммунную недостаточность. Наконец, благодаря многочисленным исследованиям 8-оксогуанин-ДНК-гликозилазы человека удалось открыть варианты этого фермента, повышающие чувствительность к заболеванию раком легких у курильщиков и людей, дышащих сильно загрязненным воздухом.
Лабораторные мыши с определенным дефектом системы репарации («ремонта») ДНК страдают «метаболическим синдромом» — ожирением, гипертонией, склонностью к диабетуА в начале 2006 г. американские исследователи из Орегонского университета создали еще одну линию нокаутных мышек, выключив у них на этот раз ген ДНК-гликозилазы NEIL1. И вновь мутанты ничем не отличались от нормальных зверьков в отношении частоты возникновения раковых опухолей.
Однако совершенно неожиданно для себя ученые обнаружили, что эти мыши все же больны. Они страдают так называемым метаболическим синдромом — бичом современного цивилизованного мира, сопровождающимся ожирением, повышением давления, диабетом... Пока остается загадкой, каким образом отсутствие гена NEIL1 приводит к результату, совершенно нетипичному для дефектов в других системах репарации. Может быть, он работает только в определенных клетках организма — например, в районах мозга, которые регулируют аппетит?
Над решением этих и других подобных вопросов и работают новосибирские ученые в сотрудничестве — а бывает, и в остром соперничестве — с коллегами из России и из-за рубежа. «Ржавая» ДНК хранит еще много тайн.
В публикации использованы фотографии автора и трехмерные изображения молекул, выполненные в программе PyMOL (DeLano Scientific)