Мы сможем жить дольше с «белком долголетия» как у гренландского кита
Знаете ли вы, что продолжительность жизни у разных млекопитающих отличается чуть ли не в 200 раз? Чтобы понять механизмы старения, ученые изучают ход возрастных процессов на коротко- и долгоживущих животных, открывая все новые и новые факты, которые могут использоваться для разработки методов лечения возраст-зависимых заболеваний и увеличения продолжительности и качества жизни человека
Факт первый, пессимистичный: в клетках нашего тела постоянно возникает множество повреждений ДНК, наследственного материала, который, как дирижер, управляет сложнейшими процессами жизнедеятельности. Изменить этот факт невозможно хотя бы потому, что многие такие повреждения вызваны агентами, образующимися в ходе нормальных метаболических и физиологических процессов. Факт второй, оптимистичный: свое самое сокровенное наши клетки умеют защищать с помощью специальных систем репарации (ремонта) ДНК. Увы, с возрастом их эффективность снижается, что приводит к накоплению в клетках геномных перестроек и других патологических изменений.
Ученые давно предположили, что репарация ДНК играет важную роль в процессах, обеспечивающих долголетие организма. Известно, что мутации в генах, кодирующих ферменты репарации, вызывают ускоренное старение не только у лабораторных животных, но и у людей. А у долгоживущих животных обнаружена более высокая устойчивость к генотоксическому стрессу. Однако требуется получить прямые доказательства связи эффективности репарации ДНК и продолжительности жизни, а также разобраться в молекулярных механизмах, которые эту связь опосредуют.
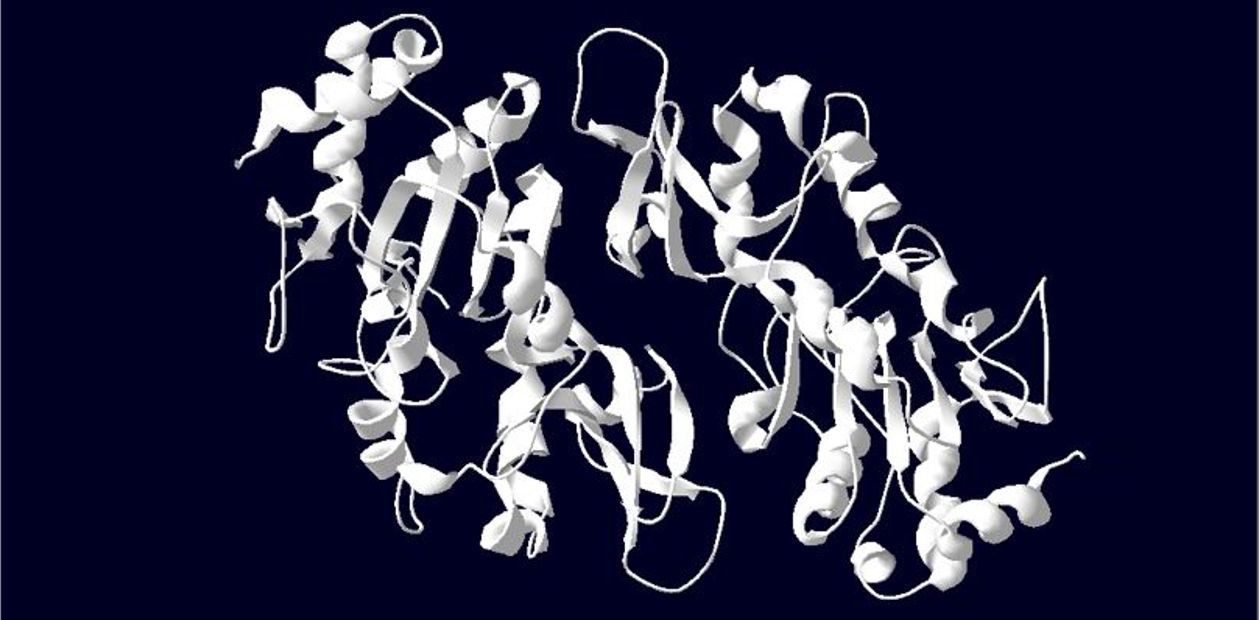
Дело это непростое, так как в работе систем репарации участвует много белков: как тех, что непосредственно осуществляют «ремонт», так и косвенно участвующих в этом процессе, помогая и направляя. При этом попытки повысить эффективность репарации, усиливая активность соответствующих ферментов, оказались в основном неудачными. Единственным исключением стал ген SIRT6, кодирующий белок сиртуин-6: увеличение активности этого гена повышало эффективность репарации двухцепочечных разрывов ДНК, не вызывая негативных побочных эффектов. Ген SIRT6 еще часто называют «геном долголетия», потому что лабораторные мыши с «выключенным» SIRT6 живут меньше, а со сверхактивным – дольше, чем обычные особи.
Большая команда ученых из Рочестерского университета (США) решили выяснить, насколько различается активность белка сиртуин-6 у короткоживущих и долгоживущих животных, и не может ли он стать терапевтической мишенью в геронтологии?
Для этого они проанализировали эффективность работы систем репарации у 18 видов грызунов. Эта группа млекопитающих служит очень удобной моделью для проведения сравнительных исследований процессов старения, так как при большой эволюционной близости грызуны отличаются чрезвычайным разнообразием продолжительности жизни: от трех (мыши) до 32 лет (голые землекопы и бобры). Исследователи уделили внимание не только репарации двухцепочечных разрывов ДНК, но и эксцизионной репарации нуклеотидов, с помощью которой удаляются объемные повреждения, искажающие структуру двойной спирали ДНК.
Выяснилось, что эффективность работы эксцизионной репарации не связана явным образом с продолжительностью жизни. Но эти данные нельзя считать окончательными, так как исследователи сравнивали виды, ведущие разный образ жизни. А основная причина объемных повреждений ДНК – солнечный ультрафиолет, поэтому на вектор отбора мог повлиять ночной или дневной характер активности животных.
Что касается репарации двухцепочечных разрывов ДНК, то они влекут за собой такие серьезнейшие последствия, как остановка клеточного деления и даже гибель клетки. Если разрывы неправильно отремонтировать, могут произойти перестройки не только последовательности отдельных генов, но и самой структуры хроматина, основы хромосом. Итог – глобальные нарушения работы генов и, как следствие, дисфункция тканей и органов, что несовместимо с долгой жизнью.
Ученые выяснили, что белок сиртуин-6, участвующий в репарации двухцепочечных разрывов ДНК, действительно работает более эффективно у долгоживущих грызунов. Проанализировав структуру этого белка у мыши и бобра, они определили, что разница обеспечивается всего пятью звеньями-аминокислотами!
С помощью методов генной инженерии исследователи вставили в клетки человека с «выключенным» геном SIRT6 соответствующие гены бобра или мыши, и получили ожидаемый эффект: клетки с «бобровым» геном эффективнее боролись с повреждением ДНК по сравнению с клетками, содержавшими «мышиный» SIRT6. А на плодовых мушках (дрозофилах), любимом экспериментальном объекте генетиков, ученые доказали, что «бобровый» ген не только лучше справляется с повреждениями ДНК в культуре клеток, но и увеличивает продолжительность жизни целостного организма. В дальнейшем ученые планируют изучить SIRT6 у видов, которые живут дольше человека, таких, как гренландский кит, достигающий возраста 200 лет и более.
Полученные результаты открывают исследователям путь к разработке конкретных фармакологических стратегий, направленных на повышение активности «белка долголетия» у человека. Например, можно создать малые молекулы, те самые пресловутые «пилюли молодости», которые будут менять конформацию (пространственную структуру) белка, чтобы она соответствовала таковой у долгоживущих животных. Подобные синтетические активаторы могут сделать репарацию нашей ДНК эффективнее, а жизнь – дольше или, по крайней мере, здоровее.
Фото: https://commons.wikimedia.org
Подготовила Мария Перепечаева